El hidrógeno es el elemento más abundante del universo, una pieza clave en la formación de estrellas y galaxias. Sin embargo, sorprendentemente, en la Tierra prácticamente no existe en su forma pura —es decir, como H₂ libre—, sino siempre combinado en moléculas como agua, hidrocarburos o amoníaco. ¿Por qué ocurre esto? Este artículo explora, de forma divulgativa y avanzada, las razones físicas y químicas que impiden que el hidrógeno puro se acumule en la atmósfera terrestre.
1. El hidrógeno es demasiado ligero y escapa al espacio
El hidrógeno molecular (H₂) es extremadamente ligero. En la atmósfera terrestre, las moléculas más ligeras tienen mayor velocidad térmica y son más propensas a alcanzar la velocidad de escape del planeta. Con una temperatura promedio de la estratosfera (cerca de 200 K), muchas moléculas de hidrógeno alcanzan velocidades superiores a la velocidad de escape (~11 km/s). Como resultado, cuando se forma hidrógeno libre en las capas altas, se dispersa rápidamente hacia el espacio, impidiendo su acumulación.
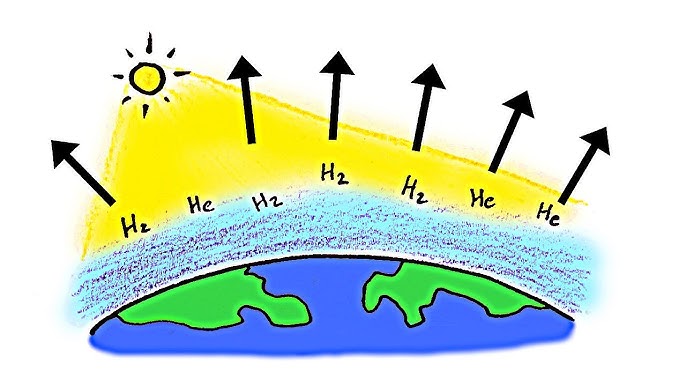
2. Reacciona fácilmente con otros elementos
El hidrógeno es químicamente muy reactivo. En condiciones terrestres, reacciona fácilmente con oxígeno para formar agua (H₂O), con carbono para formar metano (CH₄) o con nitrógeno para formar amoníaco (NH₃). Estas moléculas son mucho más estables a temperatura ambiente y se convierten en el refugio natural del hidrógeno libre. Por eso, aunque haya hidrógeno, casi siempre lo encontramos integrado en compuestos.
3. La historia del hidrógeno en la Tierra primitiva
Cuando la Tierra se formó, el material planetario era caliente y rico en hidrógeno. Pero debido a la intensa radiación solar, el escape atmosférico fue masivo. Además, el intercambio químico con la corteza y el océanica capturó gran parte del hidrógeno en compuestos como agua y minerales hidratados. Con el tiempo, casi todo el hidrógeno disponible terminó atrapado en compuestos, no en forma libre.
4. Hidrógeno en origen, pero no en estado puro
Hoy, los volcanes y respiración biológica liberan hidrógeno, pero en trazas infinitesimales (menos del 0.00005 % en la atmósfera). Cada vez que se genera hidrógeno, inmediatamente entra en reacciones químicas o escapa al espacio. Por ello, nunca se acumula en forma molecular pura. Además, el ciclo del hidrógeno está estrechamente ligado al ciclo del agua: cualquier hidrógeno liberado termina en H₂O, cerrando el ciclo sin dejar H₂ libre.

5. Consecuencias prácticas y científicas
- El uso del hidrógeno como combustible implica generarlo, por ejemplo, por electrólisis del agua, ya que no se encuentra en estado puro y libre.
- Las atmósferas planetarias, como la de Venus o Marte, muestran concentraciones variable de hidrógeno, pero siempre ligadas a compuestos derivados del agua, metano o percloratos.
- La composición primaria del planeta —rica en oxígeno y silicio como la Tierra— hace que el ambiente sea químicamente hostil a H₂ libre, a diferencia de planetas gigantes gaseosos donde se acumula en gran cantidad.
Síntesis: ¿Por qué no hay hidrógeno puro en la Tierra?
| Factor | Efecto |
|---|---|
| Liviano | Se escapa al espacio por alta velocidad térmica |
| Altamente reactivo | Se combina rápidamente con O, C, N, formando compuestos |
| Historia planetaria | El hidrógeno fue atrapado o escapó en la formación |
| Ciclos biogeoquímicos | No permanece libre, sino que cierra ciclo como H₂O |
¿Qué implica esto para el futuro?
El hidrógeno como fuente de energía sí es viable, pero requiere producción industrial (p. ej. hidrógeno verde), porque no lo extraemos de la atmósfera. Comprender su comportamiento también es clave para estudiar exoplanetas, evolución planetaria y ciclos elementales en distintos entornos del cosmos.
Conclusión
El hidrógeno, aunque abundante en el universo, no aparece libre en la Tierra por tres razones fundamentales: su ligereza que lo hace escapar al espacio, su alta reactividad que lo hace combinarse en compuestos, y la historia de nuestra planeta que lo ha integrado profundamente en su geología y biología. El hidrógeno puro requiere condiciones especiales para existir, condiciones que, en nuestro mundo, simplemente no se dan.








